Ядерная (планетарная) модель атома: как Резерфорд в 1911 году разнёс «пудинг» Томсона и изменил физику навсегда
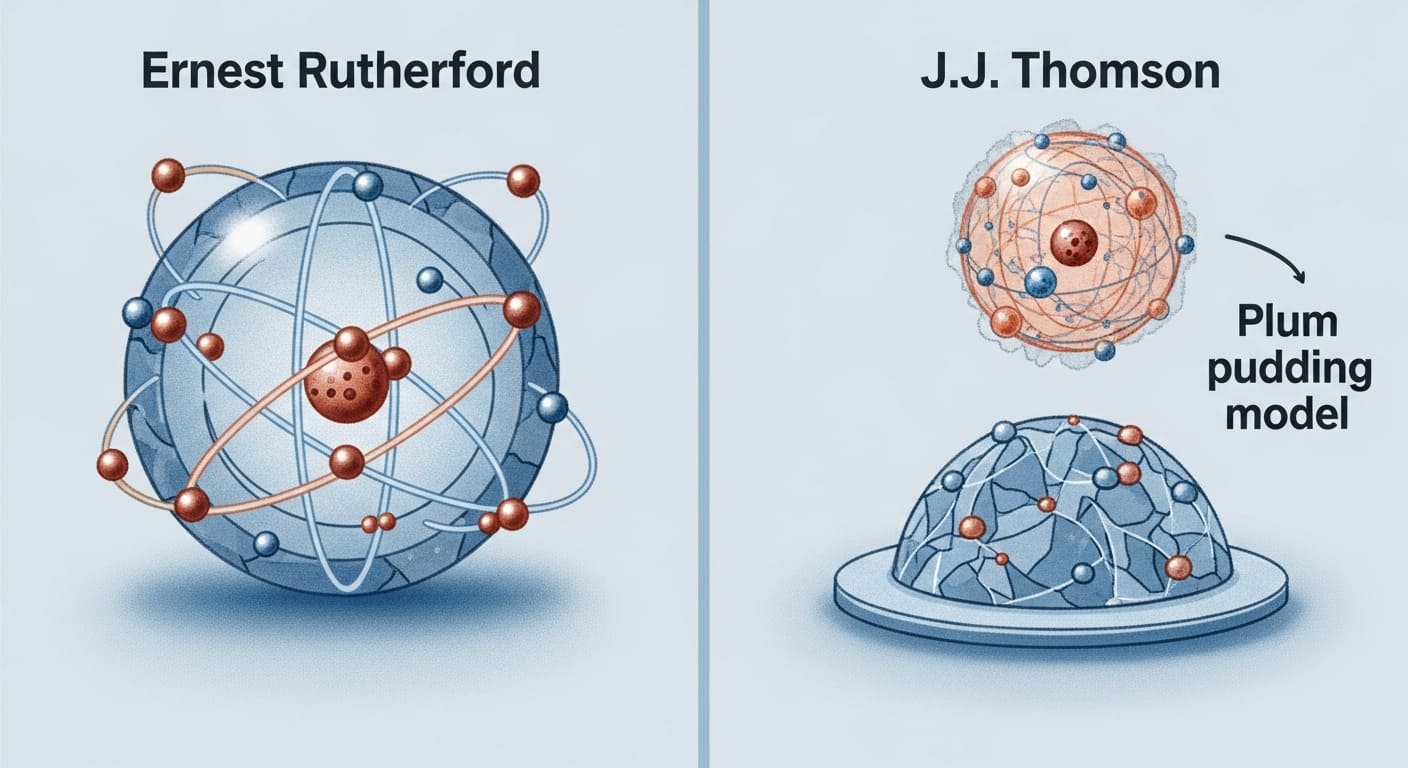
Забудьте всё, что вам рассказывали в школе про «неделимые» атомы. В 1911 году Эрнест Резерфорд с коллегами Гансом Гейгером и Эрнестом Марсденом провели эксперимент, который не просто поправил учебники, а снес в пух и прах тогдашние представления о материи. Всё, что было до — устарело в один день. Это не теория, это прямой удар альфа-частицами по научной догме. И результат? Атом — это не пудинг с изюмом, а практически пустота с крошечным, но невероятно плотным ядром в центре. Всё остальное — вращающиеся электроны, и ничего больше. Это и есть ядерная, или планетарная, модель атома. Коротко, жёстко и по делу: именно она легла в основу всей современной атомной и ядерной физики. Без неё — ни атомной энергетики, ни ядерного оружия, ни даже понимания, из чего вы, собственно, состоите.
Как рухнула модель Томсона и почему «пудинг» оказался ненастоящим
До 1911 года научный мир спокойно жил с моделью Джозефа Томсона, которую метко прозвали «пудингом с изюмом». Согласно ей, атом представлял собой однородный шар положительного заряда, внутри которого, как изюминки, плавали отрицательные электроны. Казалось бы, всё логично и стабильно. Вот только это была полная чушь, подтверждённая экспериментом задним числом. Проблема «пудинга» была в том, что он не мог объяснить элементарные физические явления. И Резерфорд это прекрасно понимал. Поэтому он решил проверить теорию не на словах, а на деле — направив поток альфа-частиц (тяжёлых и положительно заряженных ядер гелия) на тончайшую золотую фольгу.
Классическая физика и модель Томсона предсказывали, что альфа-частицы должны проходить сквозь атом почти без отклонений, слегка рассеиваясь из-за однородного положительного поля. Но в реальности большинство частиц действительно прошли насквозь… а вот некоторые отскочили назад под углами больше 90 градусов. Это было настолько абсурдно, что Резерфорд позже сказал: «Это было так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, и он бы отскочил и попал вам в голову». Такой результат был возможен только в одном случае: если вся масса и положительный заряд атома сосредоточены не в размытом облаке, а в крошечной, сверхплотной точке — ядре.
Этот эксперимент Гейгера-Марсдена стал последним гвоздём в гроб устаревшей модели. «Пудинг» не выдержал столкновения с реальностью. Его не просто улучшили — его выбросили на свалку истории. Резерфорд показал, что атом на 99.999% состоит из пустоты, а его масса сконцентрирована в ядре, диаметр которого в десятки тысяч раз меньше самого атома. Это была не эволюция, а революция в понимании строения материи. И всё это — благодаря простому, но гениально поставленному опыту с кусочком золота.
Суть модели Резерфорда: четыре постулата, изменившие мир
Модель Резерфорда базируется на четырёх ключевых положениях, которые и по сей день являются основой нашего понимания атома. Их формулировка была прямолинейной и не терпела компромиссов.
- Атом состоит из центрального ядра, которое несёт практически всю массу атома и его положительный заряд.
- Электроны, обладающие отрицательным зарядом, движутся вокруг этого ядра по замкнутым орбитам, как планеты вокруг Солнца (отсюда и название «планетарная»).
- Размер ядра ничтожно мал по сравнению с размером всего атома; всё остальное пространство — вакуум.
- Система удерживается вместе за счёт кулоновских сил притяжения между положительно заряженным ядром и отрицательными электронами.
Эта модель была прорывом, потому что она была не абстрактной догадкой, а прямым следствием экспериментальных данных. Она объясняла, почему атомы в целом электрически нейтральны, почему они могут быть стабильны в пространстве и как они взаимодействуют при столкновениях. Резерфорд фактически создал карту внутреннего мира материи, по которой физики идут до сих пор. Да, позже выяснилось, что ядро состоит из протонов и нейтронов (хотя нейтрон был открыт только в 1932 году), но сама идея центрального ядра осталась незыблемой. Это не «одна из моделей», это фундамент, на котором стоит всё здание современной физики.
Недостатки модели и дорога к Бору: почему планетам не жить по законам классики
Несмотря на всю свою гениальность, модель Резерфорда имела один фатальный изъян, который вскоре стал очевиден. Согласно классической электродинамике, любой заряженный объект, движущийся по кривой траектории (а орбита — это кривая), должен излучать энергию в виде электромагнитных волн. Это означало, что электрон, вращающийся вокруг ядра, должен был непрерывно терять энергию, спирально падать внутрь и в конце концов врезаться в ядро. Время жизни такого атома по классическим законам составляло бы доли секунды. Но раз мы существуем, атомы явно стабильны. Значит, классическая физика здесь бессильна.
Эту проблему решил Нильс Бор в 1913 году, введя в модель Резерфорда постулаты квантовой теории. Он предположил, что электроны могут двигаться только по определённым, стационарным орбитам, на которых они не излучают энергию. Энергия излучается или поглощается только тогда, когда электрон «прыгает» с одной орбиты на другую. Это было уже не чисто классическое описание, а шаг в новую, квантовую эру. Но важно понимать: Бор не ломал модель Резерфорда, он её дорабатывал. Ядро осталось, планетарная структура осталась. Просто законы, по которым двигаются электроны, оказались иными. Резерфорд дал нам карту, а Бор — правила дорожного движения по этой карте.
Зачем это всё знать сегодня и как модель работает на практике
Многие считают, что планетарная модель — это пережиток, школьная упрощёнка для двоечников. Это грубейшая ошибка. Да, для точных расчётов атомных взаимодействий нужны сложные квантово-механические модели с электронными облаками. Но планетарная модель — это не упрощение, это интуитивная и визуально понятная основа. Она позволяет мгновенно понять, что такое ядро, что такое изотопы (одинаковое ядро, разное количество нейтронов), почему альфа- и бета-излучение связаны именно с ядром, а не с электронной оболочкой. Она объясняет принцип работы ядерных реакторов и суть радиоактивного распада.
Без понимания ядерной модели невозможно осмыслить ни современную химию, ни материаловедение, ни даже биологию на молекулярном уровне. Она — тот самый первый кирпич в фундаменте научной грамотности. Ирония в том, что её открытие было делом не теоретиков в кабинетах, а экспериментаторов, которые просто решили посмотреть, что произойдёт, если «выстрелить» по атому. Так что в следующий раз, когда вы услышите словосочетание «атомное ядро», помните: это не абстракция, это реальность, которую открыл Резерфорд в 1911 году, разбив в пух и прах «пудинг» и изменив мир навсегда.
